Voda je neophodna svim živim bićima, od najjednostavnijih bakterija do čovjeka. Savršeno je okruženje za složene biokemijske procese koji se stalno odvijaju u našem tijelu. Već vjerojatno znate da molekulu vode čine 2 atoma vodika i jedan atom kisika. No jeste li znali da je voda jedina tvar koju nalazimo u 3 agregatna stanja: krutom, tekućem i plinovitom? A znate li zašto je voda univerzalno otapalo? Istražimo zajedno magična svojstva vode
Zemlja, zrak, voda i vatra. Kroz povijest ih se često smatralo primarnim elementima i esencijom života. Danas znamo da to uopće nisu elementi, već nešto posve drugo. Vatra je, na primjer, kemijska reakcija između kisika u zraku i goriva poput drveta ili ugljena. Zemlja i zrak su kombinacije raznih elemenata.
Voda je molekula koja se sastoji od dva atoma vodika i jednog atoma kisika. Antički filozofi su ipak donekle bili u pravu – voda je esencija života. Postoji razlog zašto su se sve antičke civilizacije razvile kraj izvora vode. Život, bar onaj koji mi poznajemo, ovisi o vodi.
Voda u ljudskom tijelu
Naše tijelo sadrži 65% vode. To je jako velik udio! No, još zanimljivije je to da pojedini organi poput srca i mozga (73%) kao i pluća (83%) ovise o vodi još više.
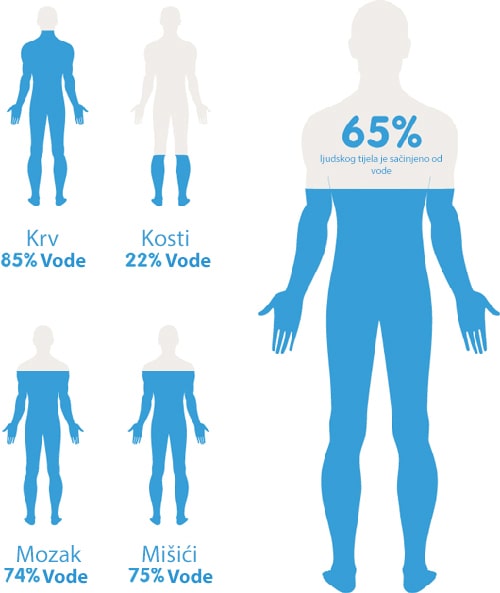
Voda je primarna fiziološka potreba, moramo piti oko 2 L vode na dan kako bismo preživjeli. A u slučaju dehidracije, naš se mozak prebacuje u sustav štednje vode. To za posljedicu ima smanjenje kognitivnih funkcija kako bi se prioritet dao osnovnim biološkim potrebama. Voda ima razne uloge u našem tijelu. Možda najočitija je regulacije tjelesne temperature kroz znojenje. No, glavna uloga vode je osiguravanje potrebne energije svakoj stanici u našem tijelu. Voda pomaže preradi i transportu hrane kao i odvodu otpada. Sastavni je dio sline te pomaže i podmazivanju zglobova. Zaista je neophodna za svakodnevno funkcioniranje našeg tijela.
Kemijska struktura vode
Strukturalno, molekula vode ima izgled slova V. Formula (H2O) je vjerojatno dobro poznata svima. Dva atoma vodika i jedan atom kisika povezani kovalentnom vezom. To znači da kisik i vodik dijele par elektrona, ne prenose ih s atoma na atom.
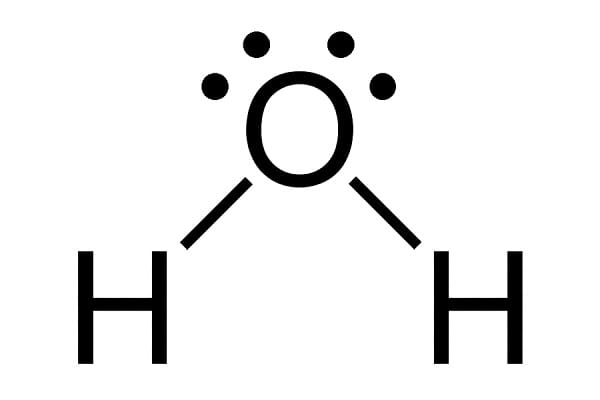
Kisk je elektronegativniji od vodika, “pohlepniji” za elektrone, stoga ima djelomično negativan naboj. Vodik manje želi elektrone pa ima djelomično pozitivan naboj. To dovodi do toga da vrh molekule (kisik) ima negativan naboj, a drugi kraj (gdje su dvoje molekule vodika) pozitivan. Takav tip molekule nazivamo polarnom molekulom. Zbog polarnosti se molekule vode međusobno jako privlače. Pozitivni dio jedne molekule privlači negativni dio druge molekule vode. Kažemo kako su molekule vode međusobno povezane vodikovom vezom. To dovodi do brojnim zanimljivih svojstava koje ćemo dalje istražiti.
Kohezija i adhezija
Kohezija i adhezija definiraju koliko je tvar “ljepljiva”. Kohezija je privlačnost između istih molekula, na primjer više molekula vode. Adhezija je privlačnost između različitih tvari, na primjer molekule vode i stakla. Voda ima visoku kohezivnost, najvišu od svih nemetala. To znači da se molekule vode vole držati zajedno (sjećate se vodikovih veza?). Možete to vidjeti i sami ako isprobate sljedeći eksperiment. Promatrajte kako se ponašaju kapljice vode na papiru za pečenje. Kaplice vode zadržavaju svoj oblik i ne razlijevaju se lako.

No postoje naravno slučajevi kada su adhezivne sile jače od kohezivnih.
Jeste ikada promatrali vodu na staklu? Vrlo brzo postane samo mokra lokva, za razliku od elegantnih kapljica koje smo vidjeli na papiru. Zašto? Molekule stakla su vrlo polarne, polarnije i od molekula vode, stoga su one privlačnije. To je adhezija. Adhezija i kohezija djeluju zajedničkim snagama u puno važnih bioloških procesa. Na primjer, kapilarnost, kretanje vode u uzvodnom smjeru, opirući se gravitaciji. Na ovom principu biljke izvlače vodu iz korjena, a slično funkcionira i naš krvožilni sustav.
Univerzalno otapalo
Otapalo je tekućina koja otapa druge tvari – tekuće, krute ili plinovite. A voda može otopiti više tvari nego ijedna druga tekućina. Zato ju i nazivamo univerzalnim otapalom. Tvari koje otapamo u vodi zovemo otopljene tvari.
Kako je voda polarna, može otapati druge polarne molekule kao i ione. Primjeri uključuju kuhinjsku sol, šećer i prehrambene boje. Molekule koje se otapaju u vodi nazivamo i hidrofilnim molekulama. Molekule koje se ne miješaju s vodom, kao što su ulja, nazivamo hidrofobnim molekulama. Nepolarne molekule ometaju stvaranje vodikovih veza između molekula vode, a rezultat toga je da se ne otapaju u vodi. Ovo svojstvo detaljnije smo istražili u aktivnosti izrade lava lampe pa probajte ako želite znati više.
Gustoća i toplinski kapacitet vode
Znate li da je voda jedina tvar na zemlji koju nalazimo u sva tri stanja: čvrstom, tekućem i plinovitom? I ima još jedno neobično svojstvo: Gustoća voda je viša u tekućem nego u krutom stanju. To je jedinstveno za vodu. No kako do toga dolazi? Na oko 0 stupnjeva Celzijusa, vodikove veze počinju formirati kristalnu strukturu. U takvoj strukturi, atomi su puno udaljeniji tako da je gustoća niža. Zato led pluta na vodi!

Voda ima i jako visok toplinski kapacitet. Najviši među tekućinama! To znači da može apsorbirati puno toplinske energije prije nego što joj temperatura poraste. A i suprotno je točno, voda se jako sporo hladi. Ako ste ikad bili na moru, znate da je klima tamo puno ugodnija. Voda služi kao međuspremnik koji sprječava velike temperaturne promjene.
Kako je voda velik dio ljudskog tijela, to i nama pomaže u održavanju tjelesne temperature. Sjetite se različitih vremenskih uvjeta u kojima ljudi žive, hladnih zima i vrelih ljeta. Podnosimo to bez velikih teškoća baš zato što naše tijelo koristi toplinski kapacitet vode. Ako želite vidjeti ovo svojstvo u akciji, pogledajte 5 zanimljivih eksperimenata s balonima gdje ga detaljno istražujemo.
To bi bilo sve od nas ali je tek početak djelovanja magičnih karakteristika vode. Ako vam se svidio ovaj članak, preporučujemo da probate još malo eksperimenata. Zašto ne probate napraviti vlastitu plastiku? Također, možete istražiti osmozu pomoću gumenih bombona ili Difuziju pomoću tople i hladne vode. Očekuje vas puno, puno uzbudljivih znanstvenih avantura.
Pogledajte ostale aktivnosti iz kategorija…

STEM Znanost
Video, objašnjenja i korak po korak upute za aktivnosti iz STEM znanosti s materijalima koje već vjerojatno imate kod kuće. Pronađite nove ideje iz znanosti
Nastavi Čitati
STEM Tehnologija
Video, objašnjenja i korak po korak upute za aktivnosti iz STEM tehnologije s materijalima koje već vjerojatno imate kod kuće. Nove ideje iz Tehnologije.
Nastavi Čitati
STEM Inženjerstvo
Video, objašnjenja i korak po korak upute za aktivnosti iz STEM Inženjerstva s materijalima koje već vjerojatno imate kod kuće. Nove ideje iz inženjerstva!
Nastavi Čitati
STEM Matematika
Video, objašnjenja i korak po korak upute za aktivnosti iz STEM matematike s materijalima koje već vjerojatno imate kod kuće. Nove ideje iz Matematike.
Nastavi Čitati
Psihologija
Saznajte sve o temama koje su vas oduvijek zanimale iz područja razvojne psihologije. Najčešći problemi pri rastu i razvoju djece te kako im pristupiti.
Nastavi Čitati
Prva godina djetetovog života
Pratimo razvoj djeteta mjesec kroz mjesec i donosimo vam osobna iskustva te savjete kako se nositi s izazovima s kojima ćete se zasigurno susresti.
Nastavi Čitati